Dra. Irene Castaño Navarro, Investigadora DBM IPICYT.
Gracias a la ciencia guiada por la curiosidad se descubrió una especie de sistema inmune en bacterias que se conoce como CRISPR-Cas. Dos científicas, Jennifer Doudna y Emmanuelle Charpentier, se dieron cuenta de que este sistema se puede usar para para curar enfermedades devastadoras como la leucemia y anemia falciforme.
La leucemia, que es un tipo de cáncer frecuente en niños, ocurre cuando los glóbulos blancos del sistema inmune de defensa (que se producen en la médula ósea), se empiezan a multiplicar sin ningún control y afectan la producción de las demás células que componen la sangre. La leucemia se trata con quimioterapia y trasplante de médula ósea y suelen obtenerse muy buenos resultados.
Sin embargo, hay ciertos tipos de leucemia que no responden a ninguno de estos dos tratamientos, como la que padece Alyssa, una niña de 13 años que vive en la ciudad de Leicester, Reino Unido. El problema es que el tipo de leucemia de Alyssa involucra a otro tipo de glóbulos blancos conocidos como células T. Las células T son parte del sistema inmunológico y nos defienden de las infecciones y de tumores, pero las células T de Alyssa se empezaron a multiplicar fuera de control.
Afortunadamente, el trabajo de las científicas Doudna y Charpentier permitió el desarrollo, durante los últimos seis años, de terapias experimentales basadas en la edición genómica. Este tratamiento se usa para corregir defectos genéticos y se basa en la tecnología CRISPR-Cas. Alyssa fue la primera persona que participó, en mayo de 2022, en un ensayo clínico con este tipo de terapia. Hasta el día de hoy permanece libre de células cancerosas.
En el material genético de las células se encuentran las instrucciones para producir proteínas que son esenciales para realizar funciones vitales como la respiración y la multiplicación celular. Estas instrucciones existen en forma de una molécula larga llamada ADN (ácido desoxirribonucleico), que consiste en un código de cuatro letras que se leen para producir proteínas. Un gen es una secuencia específica de letras que produce una proteína. Cuando ocurren errores en la secuencia de las letras de un gen, a veces dan como resultado proteínas defectuosas que pueden causar enfermedades genéticas como la anemia falciforme, algunos tipos de cáncer, la fibrosis cística, etc.
Lo extraordinario de la tecnología CRISPR-Cas consiste en que se pueden corregir errores genéticos de manera eficiente y precisa. Es decir, se puede editar la secuencia de las letras de un gen como cuando corregimos un texto: se puede borrar una secuencia de letras y sustituir por otras nuevas o se puede corregir solo una letra. Al término de la edición, la secuencia que queda es la correcta.
Esto se logra al introducir a las células que contienen el gen que se quiere editar, la maquinaria de CRISPR-Cas, que consiste en una especie de “tijeras moleculares”. Esta maquinaria para “corte y reparación molecular” puede localizar eficientemente el gen que desea editarse, cortar en el lugar que contiene el error y corregirlo.
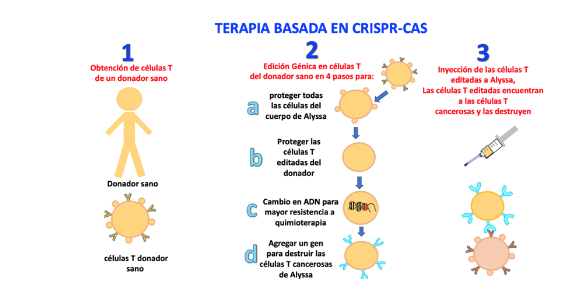
En el caso de Alyssa, la edición génica para su tratamiento consistió primero en obtener células T de un donador sano y realizar en ellas cuatro cambios (ediciones) en el genoma mediante la corrección de una sola letra en cada uno.
- La primera edición de las células T del donador fue para proteger a todas las células de Alyssa, ya que podrían ser atacadas por las células T del donador. La edición eliminó un gen que produce una proteína que podría destruir las células de Alyssa.
- La segunda edición fue para proteger las células T del donador, ya que el sistema inmune de Alyssa las atacaría al reconocerlas como ajenas. Es decir, se eliminó otro gen en las células T del donador que las identifica como células que no pertenecen a Alyssa.
- La tercera edición de las células T del donador consistió en introducir un cambio en un gen que las vuelve más resistentes a la quimioterapia.
- La cuarta edición consistió en agregar un gen que produce que las células T del donador maten exclusivamente a las células T de Alyssa y no otras células de su cuerpo. Es decir, las células editadas del donador eliminan solamente a todas las células T de Alyssa, incluyendo sus células T cancerosas.
Una vez que Alyssa terminó el tratamiento, su cáncer entró en remisión. Posteriormente recibió otro trasplante de médula ósea, porque la terapia mató todas sus células T. Seis meses después, el cáncer de Alyssa ya no se detectó. Alyssa ahora goza de una vida normal, vive en casa, regresó al colegio y está disfrutando de las vacaciones de fin de año.
Otro ejemplo exitoso del uso de CRISPR-Cas para curar una enfermedad hereditaria es el caso de Victoria Gray, una mujer de 36 años de edad que vive en Mississippi, EUA. Victoria sufre de anemia falciforme causada por un gen defectuoso que produce una hemoglobina defectuosa. La hemoglobina es la proteína que lleva el oxígeno a todas las células del cuerpo y está en los glóbulos rojos.
Los glóbulos rojos de quienes tienen esta enfermedad, que contienen la hemoglobina defectuosa, son más grandes y tienen forma de C, en vez de la forma redonda normal. Estos glóbulos rojos anormales pueden tapar los vasos sanguíneos pequeños y provocar trombosis y dolores musculares muy intensos. Victoria constantemente tenía que internarse en el hospital para recibir transfusiones de sangre porque los glóbulos rojos anormales duran menos tiempo en la sangre, y esto le producía anemia grave y una fatiga muy intensa que le impedía llevar una vida normal.
En el verano de 2019, Victoria se sometió a una terapia génica basada en CRISPR-Cas que consistió en tomar células de su propia médula ósea, que dan origen a todas las células sanguíneas, y, mediante CRISPR-Cas, editarlas de manera que ahora pudieran producir una hemoglobina embrionaria que normalmente no se produce en células adultas. Estas células editadas se reintrodujeron al torrente sanguíneo de Victoria con la expectativa de que se reprodujeran en su médula ósea y empezaran a producir la forma embrionaria de la hemoglobina, de manera que se compensara la falta de oxigenación de la hemoglobina defectuosa.
Dos años después del procedimiento, Victoria tiene una vida normal y no ha tenido que regresar al hospital para tratar ningún episodio de dolor, trombosis o anemia, debido a que las células editadas que se le reintrodujeron han seguido multiplicándose y produciendo hemoglobina embrionaria.
En los ejemplos descritos, las terapias basadas en CRISPR-Cas realmente han cambiado la vida de las pacientes y les han permitido reincorporarse a una vida normal gracias a que el tratamiento ha sido como una “terapia viva” que perdura años después.
En 2020 Jennifer Doudna y Emmanuelle Charpentier recibieron el premio Nobel de Química por el desarrollo de CRISPR como una caja de herramientas para la edición genómica, y desde 2014, a dos años del descubrimiento de CRISPR-Cas, Jennifer Doudna impulsó que esta tecnología se utilizara para el tratamiento de la anemia falciforme.
Actualmente, a solo seis años de usar CRISPR-Cas como terapia génica, ya hay múltiples ensayos clínicos para probar la seguridad y eficacia de variantes de terapias basadas en CRISPR-Cas para el tratamiento de diferentes enfermedades hereditarias. También se están desarrollando nuevas aplicaciones de CRISPR que tienen el potencial de revolucionar la medicina para todo el mundo mediante la generación de variantes más precisas de CRISPR o que modifican la estructura química del ADN, sin cortarlo, para modificar su actividad. Todas estas variantes también se pueden utilizar en medicina preventiva para editar genes asociados con el riesgo de desarrollar alguna enfermedad como presión alta o enfermedades cardiovasculares.
Muchos de estos ensayos clínicos están dirigidos por consorcios de instituciones académicas donde participan el Innovative Genomics Institute (IGI, Instituto para la Innovación en la Genómica), la Universidad de California-San Francisco (UCSF), la Universidad de California-Berkeley (UC-Berkeley), University College-London, entre otras. La visión a largo plazo es no solo mejorar la salud de las personas, sino también encontrar soluciones al enorme problema del cambio climático, mediante la edición de determinados genes de los microorganismos del suelo o de las plantas, con el objeto de mejorar su adaptación ante el cambio climático.
Estos son algunos ejemplos que ilustran claramente que la ciencia guiada por la curiosidad inevitablemente lleva a descubrimientos que cambian de manera muy positiva nuestra vida, mejorando la salud, el cuidado del medio ambiente y la alimentación.
¿Te gustaría más información sobre el tema? Envía un correo electrónico a la Doctora Irene Castaño:icastano@ipicyt.edu.mx
¿Quieres conocer más del IPICYT? Contáctanos :comunicacion@ipicyt.edu.mx